|
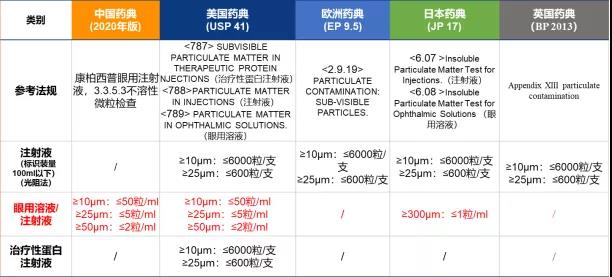
2020版《中国药典》——首个纳入眼科抗VEGF药物的药典时间:2020-10-16 药典是一个国家记载药品规格、标准的法典。药典中收载疗效确切、副作用小、质量稳定的常用药物及其制剂,规定其研发、生产、检验、流通、使用等全过程质量控制标准。 《中华人民共和国药典》(简称《中国药典》)是我国国家药品标准的重要组成部分,是国家药品标准体系的核心。我国现行《药品管理法》第十二条规定,不符合国家药品标准的药品“不得出厂”。如“出厂”则相应的药品生产行为属于违法;第四十八条规定,“禁止生产、销售假药”,而“药品所含成份与国家药品标准规定的成份不符的”即为假药。第四十九条规定,“禁止生产、销售劣药”,而“药品成份的含量不符合国家药品标准的”即为劣药。从这个视角看,《药典》是对区分相应行为合法和违法的边界进行规范。 从世界范围来看,有五个国家和地区的药典是具有重大影响力的,分别由中国、美国、欧洲、英国和日本颁布的药典(详见国家药典委员会官网“世界药典之窗”)。 抗血管内皮生长因子(vascular endothelial growth factor, VEGF)药物作为治疗眼部血管病变类疾病的一大利器,已在世界范围内广泛应用十余年,大量的临床证据已经证实了其疗效与安全性。但是在2020版《中国药典》颁布之前,主流药典并没有收录眼科抗VEGF药物。比如,美国药典只规定了眼用注射液的不溶性微粒、包装瓶、胶塞、细菌内毒素等标准和肽图、生物学活性等通用测定方法,但没有刊载针对雷珠单抗和阿柏西普等眼科抗VEGF药物的整套质量控制体系。 本着坚持科学性、先进性、规范性和权威性,不断提高药品质量标准、不断扩大和提升国际积极影响的原则,2020版《中国药典》完成修订并正式颁布,将于2020年12月30日实施。本版《中国药典》收载了我国自主研发的康柏西普(conbercept)眼用注射液,成为第一个收录眼科抗VEGF药物的药典。 康柏西普眼用注射液是利用中国仓鼠卵巢细胞表达系统生产的重组全人源融合蛋白,具有多靶点高亲和、独特双重稳定结构的优势。已获批适应症为湿性年龄相关性黄斑变性、糖尿病黄斑水肿和病理性近视脉络膜新生血管。多项大型临床随机对照试验都支持了康柏西普卓越的疗效和安全性,能够有效提高患者视力、改善眼底结构。 据介绍,2014年康柏西普眼用注射液启动筹备国际临床注册研究,在2016年即获得美国食品药品管理局(FDA)许可,免去Ⅰ期和Ⅱ期注册研究,直接开展Ⅲ期试验,随后在20个国家170多个中心顺利展开。这表明康柏西普眼用注射液的质控标准已经达到国际水平。 2020版《中国药典》收载的首个眼科抗VEGF药物,不仅建立康柏西普眼用注射液从生产、制造、检定、储存、流通到使用等全过程的高标准质量控制体系,且所有标准均不能低于同类产品标准。此外,还对包括生物学活性、唾液酸等重要项目检测方法做进一步提升,达到国际领先的要求。为此,国家药典委员会2018年设立“康柏西普质量提高”课题,最终在完成标准提高课题的验收后,按照“临床常用、疗效确切、使用安全、质量可控”的原则,通过了药学和医学评价遴选,成功将康柏西普收载入2020版《中国药典》第三部,这是该部唯一新增的融合蛋白类产品和唯一的眼用注射液生物制品,所确立的严格标准和严谨科学的检测方法,为不同批次的康柏西普眼用注射液稳定的疗效和安全性提供了可靠保障。 值得一提的是关于不溶性微粒的标准。不溶性微粒残留于眼内,可导致炎症、眼底血管栓塞和肉芽肿等严重后果,但在康柏西普眼用注射液出现之前,国内尚无玻璃体腔注射用药物,因此在以前版本的《中国药典》中没有相应的眼用注射液标准。2020版《中国药典》第一次明确规定了康柏西普的不溶性微粒标准,且高于日本、欧洲和英国颁布的药典标准,与美国药典中眼用溶液不溶性微粒标准一致。
(本文由康弘生物供稿) 上一篇中国药典的发展历史及启示(上)下一篇“药典”一词的由来 |